職位推薦
- 珍格醫療-臨床銷售 15001-20000
- 地奧制藥-醫藥代表 6001-8000
- 普利德醫療-醫療設備銷售經理 面議
- 大唐-兼職招商經理 面議
- 景德中藥-直營經理 6001-8000
- 安邦醫藥-省區招商經理 8001-10000
- 恒瑞醫藥-醫藥信息溝通專員 6001-8000
- 黃河中藥-學術講師 8001-10000
發布日期:2020-09-03 瀏覽次數:341
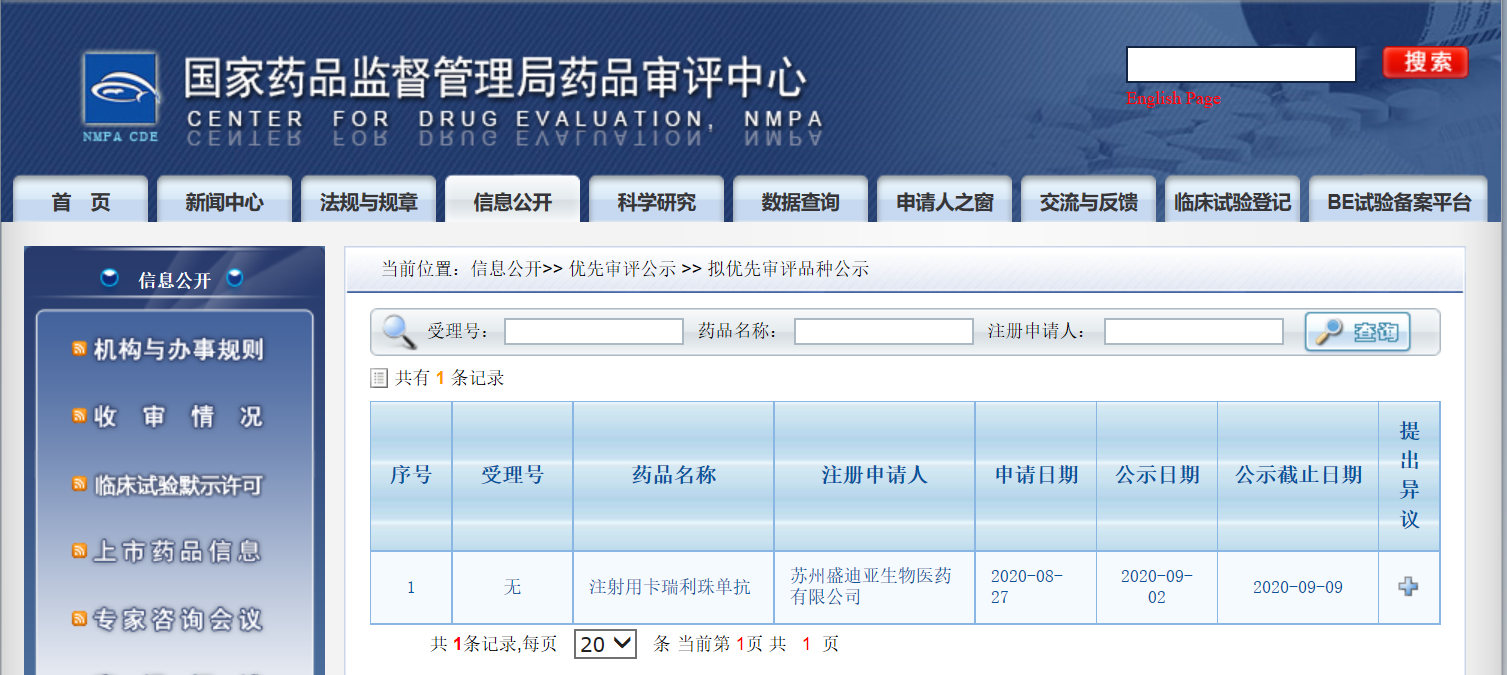
日前,恒瑞醫藥卡瑞利珠單抗晚期鼻咽癌適應癥被國家藥品監督管理局納入擬優先審評品種公示名單。
中國鼻咽癌發病率和死亡率均明顯高于世界平均水平,全球50%的鼻咽癌發生在中國。鼻咽癌具有明顯的地域分布特征,中國南方地區發病率較高,其中廣東省鼻咽癌的發病率最高。放射治療是治療早期鼻咽癌的主要方法,但大約20-37%的患者會出現局部復發或者遠處轉移。復發或轉移鼻咽癌的治療手段非常有限,預后較差。
卡瑞利珠單抗是恒瑞醫藥自主研發并具有知識產權的人源化PD-1單克隆抗體,是我國擁有自主知識產權的免疫治療創新藥,自2019年5月上市以來,已相繼獲批霍奇金淋巴瘤、晚期肝細胞癌、晚期食管鱗癌和非鱗非小細胞肺癌四個適應癥。卡瑞利珠單抗治療經二線及以上化療失敗的晚期鼻咽癌的II期關鍵性臨床研究(CAPTAIN研究)于2018年8月開始首例受試者入組,研究結果將在即將召開的ESMO大會上做口頭發言。恒瑞醫藥于2020年8月27日向國家藥品監督管理局藥品審評中心提出申請,將該產品用于既往接受過二線及以上化療后疾病進展或不可耐受的晚期鼻咽癌患者的治療,日前被納入擬優先審評品種公示名單。此外,卡瑞利珠單抗聯合順鉑和吉西他濱一線治療局部復發或遠處轉移鼻咽癌的隨機、雙盲、安慰劑對照、多中心III期臨床研究也已達到有效性終點,未來將為中國鼻咽癌患者提供更多治療選擇。
300多萬優質簡歷
17年行業積淀
2萬多家合作名企業

微信掃一掃 使用小程序

